研究開発
東京薬科大学共同研究
研究項目
ビルベリー由来アントシアニンの抗腫瘍作用に関する研究
研究目的
がん、心臓病、心筋梗塞といった生活習慣病の増加が先進国の間で大きな社会問題となっており、特に医療費の高騰化は国民の生活にとって深刻な問題となっている。これらの病気の病因は多岐にわたり、種々の原因が複雑に相互に作用し合った結果発症すると考えられており、特に環境要因・遺伝的素因は発症に重要な役割を果たしていることが知られている。
最近の研究結果から、アントシアニンが抗酸化作用、抗腫瘍作用、さらには脂質代謝に影響を与えているという知見が報告されている。このことは、ワイン(特に赤ワイン)の産地であるフランスにおいて動脈硬化症が少ないことからも、臨床的有用性が示唆されている。
我々は、生活習慣病の中でも特に”がんの発症機構解析および免疫細胞療法”に興味を持ち研究を続けてきた。そこで、この研究プロジェクトでは、ビルベリー由来アントシアニンの抗腫瘍作用について、臨床分子免疫学的観点から作用機序を明らかにし、細胞免疫療法および、これら主成分を含有する健康食品の開発を目的としている。
研究背景
最近の医学研究の進歩に伴い、がん治療分野においても、これまで不可能と思われた新しい治療法の開発が可能になってきている。
がんの免疫療法分野においても、これまで行われてきた療法に加えて天然物由来物質を用いることで、人間が本来持っている免疫活性などを強くし、がんなどの治りにくい病気になることを未然に防ぐこと(未病療法)、また病気になった患者さんに対しては、これらの物質を取ることで負担の少ない(QOL)治療法の確立が望まれている。
研究成果の応用
ここで得られた結果はこれまで知られている、アントシアニンの抗腫瘍効果に関する知識を深めることとともに、健康食品としての効用についても新しい概念を導入するものである。
この結果をもとに、他の食品との併用、新しい剤型の開発といったこれまで未知であった分野への新たな展開が期待できる。
ビルベリーの新しい効果・がん細胞の増殖を抑える効果
主にヨーロッパ等で栽培されてきたビルベリーは、古くから鮮やかな赤色や紫色等いわゆるビルベリー色の色素特性を利用することに 多く用いられてきました。その生理活性・薬効に関する研究の結果、主に眼精疲労回復、視力回復や血管の透過性改善等に有効であることもわかっております。
また最近では、ビルベリーの主成分であるアントシアニン(アントシアニジン)を含む健康飲料などの開発も進められております。ビルベリーの主成分であるアントシアニン(アントシアニジン)はフラボノイドと呼ばれる物質群に属しております。
フラボノイドは皆さんもご存知のように、葉野菜類、紅紫色の野菜・果物植物、大豆、柑橘類、そしてお茶などに含まれております。たとえば大豆に含まれるイソフラボン、お茶やカカオに含まれるカテキンなども仲間です。
ここに示したのはアントシアニジン(アントシアニンは配糖体とよばれてアントシアニジンと糖が結合したもので、糖成分がなくなったものをアグリコンと呼び、その成分がアントシアニジンです)のうち主な構成化合物を示してあります。
このようなアントシアニンを含むフラボノイドの代表的な生物活性に抗酸化作用、それに関連した発ガン抑制が知られております。このことは、たとえば、赤ワインを飲むと悪玉コレステロール(LDL)が酸化されることを防ぐ(酸化されると細胞にダメージがあたえられ、そこにコレステロールなどの沈着が起こり動脈硬化などがおこると考えられております)ことなどが経験的に知られております。
また、ヨーロッパでは、白内障、糖尿病、静脈瘤などの治療においてサプリメントとして、精製されたビルベリー抽出物80~160mg(2~3回/日、抽出物は約23~37%アントシアニンを含有)を患者さんに用いております。
そこで、ビルベリーエキス配合飲料(グローブサイエンス社)の成分であるアントシアニンのヒト腫瘍細胞の増殖に対する影響について検討しました。
大腸がん由来腫瘍細胞(COLO)、胃がん由来腫瘍細胞(KATO-III)、悪性リンパ腫由来細胞(Raji)、正常繊維芽細胞(HCF)をビルベリー果実熱抽出物存在下で培養すると、図に示したように、程度の差はあるものの、腫瘍細胞の増殖を抑えることがわかりました。この図では、悪性リンパ腫由来細胞(バーキットリンパ腫)は非常に低濃度(0.1mg/ml:アントシアニジン換算で約24µg/ml相当)で約20%程度の細胞しか生存していないことがわかりました。また、同じ消化器由来の腫瘍細胞でも大腸がん由来の腫瘍細胞のほうが、胃がん由来の腫瘍細胞と比べて細胞生存率が低い(より低濃度で細胞増殖が抑えられる)ことを示しております(図1)。
また、細胞増殖抑制に細胞死、特にアポトーシス(プログラム化された細胞死のことで、がん細胞などはこのプログラムに狂いを生じた結果、異常増殖すると言われております)により細胞の増殖が抑制されることがわかりました(図2)。
そこで、いくつかのがん細胞について検討を行ったところ、表に示したように大腸がん由来のCOLO 201細胞を除き、固形がん由来の細胞に比べて白血病由来、とくにリンパ球系由来細胞に対して強い細胞増殖抑制効果が認められました。
ただ、白血病由来細胞に対する細胞増殖抑制は、DNA断片化が認めらなかったことから、アポトーシスではない細胞死誘導機構(おそらくネクローシス)が関与している可能性が示唆されました。ここで非常に興味あることは、正常細胞(HCF)の増殖には影響を与えませんでした。
図1. 種々のがん細胞に対するビルベリー濃度
ビルベリー熱水抽出物粉末を溶かして調整した溶液(0~1mg/ml)で種々のがん細胞(2~3×105細胞/ml)を24~48時間処理後細胞生存率を測定した。
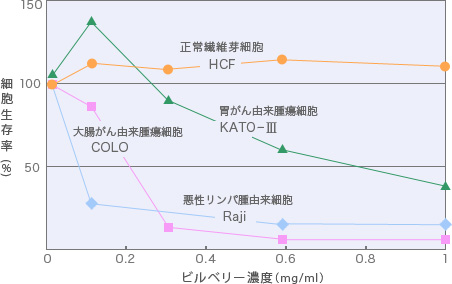
図2. ビルベリーによるアポトシス誘導
COLO 201細胞にビルベリー熱水抽出物粉末溶液(1.0mg/ml)を24時間あるいは48時間処理後、細胞よりDNAを抽出してアポトーシス誘導(DNA鎖の断片化によりサイズの異なる低分子のDNAフラグメントが認められる)の程度を測定した。
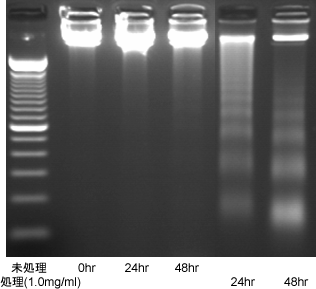
表:種々のがん細胞の増殖に対するビルベリーの効果
| IC50(mg/ml) | 細胞増殖抑制 | 細胞死誘導 | ||
|---|---|---|---|---|
| 固形がん由来 | COLO 201(大腸がん由来) | 0.03 | + | アポトーシス |
| KATO III(胃がん由来) | 0.65 | + | アポトーシス | |
| MCF-7(乳がん由来) | 0.70 | + | アポトーシス | |
| 白血病由来 | E.6.1(T細胞球由来) | 0.02 | + | ネクローシス? |
| Raji(B細胞球由来) | 0.04 | + | ネクローシス? | |
| U937(単核球由来) | 0.30 | + | ネクローシス? |
IC50:処理した細胞の1/2の細胞において細胞増殖が抑制される濃度
ネクローシス:細胞死誘導機構の一つで、アポトーシスとは異なり細胞溶解を伴う細胞死
また、ビルベリー抽出物に、抗酸化作用を有するビタミンE(最終濃度1mM:通常は200~400IUを摂取し、1mMはほぼ250IUに相当する)を混合すると、その細胞増殖抑制効果は大腸がん由来腫瘍細胞(COLO)では約50%増強されるという結果も得ております。
がん発症に大きな役割をはたしている酸化作用を防ぐ抗酸化剤として知られている、ビタミンEを添加することでその効果が増強するという以上の結果は、これまで知られていたビルベリーの効能が、抗酸化作用などを有する物質を加えることにより、より効果的に腫瘍細胞の増殖を抑えることが出来る可能性を示唆しております。
細胞増殖抑制作用は、アントシアニジンを構成している成分により、その増殖抑制効果の程度が異なることから、もっとも効果のある化合物の組み合わせを検討することも可能であるという興味ある結果も得ております。
一般的にがん治療の基本的考え方としては、予防を目的として対処法と治療を目的とした対処法が知られております。治療を目的とした対処法は、
(1)外科的手法によるがん細胞・組織の除去、
(2)化学療法・放射線療法によるがん細胞の増殖阻止、および
(3)新しい細胞免疫療法などが知られております。
しかしながら、侵襲性、副作用などの点から、患者さんの苦痛を軽減する新しい治療法の開発は常に求められており、そのために新しい治療技術の開発が精力的に行われております。このような病気になってからの治療も重要ですが、これからはますます普段から体の細胞を元気に保ち、病気にならない体を作りあげることが、高齢化社会における健康維持に欠かせない考え方かと思います。
従って、今回得られた結果を基に、これからは
(1)最も効果的な腫瘍細胞に対する細胞死誘導法について、
(2)現在行われているがん治療(化学療法、放射線療法、免疫療法など)との相乗効果について、
(3)動物モデルを用いてビルベリーを投与することで、がんの発症・進行抑制の可能性について
などを検討し、ビルベリー中に含まれるアントシアニンによる腫瘍増殖の抑制効果機序を明らかに出来ると考えております。
東京薬科大学臨床ゲノム研究室
豊田 裕夫
代表研究者略歴
氏名:豊田 裕夫
生年月日:昭和22年9月8日
略歴
昭和53年、金沢大学医学部大学院博士課程終了(がん研究所生物物理、医学博士)。
昭和54年、ミネソタ州ロチェスターにあるMayo Clinic、細胞生物部に性ステロイドの遺伝子発現におよぼす影響について研究するため博士研究員として渡米。
昭和56年から、カリフォルニア州ロサンゼルスにある City of Hope研究所において、研究スタッフとして自己免疫疾患の発症機序を合成DNAを用いて遺伝子レベルでの解析を行う。同研究所分子遺伝部長(昭和58年)
昭和62年より、UCLAの教育病院であるCedars-Sinai Medical Center、医学遺伝部(Medical Genetics)へ移り、分子生物部部長として免疫系に及ぼす性ステロイドの影響を中心に研究・教育指導・教育研究にあたる。
また平成10年から、カリフォルニア州サンタバーバラにあるRasmus(ラスムス)医学研究所副所長として、がん細胞に及ぼす性ホルモンの影響を調べるため、乳がん、前立腺肥大患者を用いて臨床試験を行っている。
米国糖尿病学会賞、米国クローン病協会賞を含め数多くの学会賞を受賞し、英国International Biographical Centerより”2000 Outstanding Scientists of the 21st Century”(21世紀に活躍した科学者2000人)に選ばれる。
平成14年4月より平成15年6月まで日本ベクトン・ディッキンソン神戸ラボの開設に携わり、その責任者として開発・研究にあたる(上級研究員)。
平成15年7月より東京薬科大学薬学部臨床ゲノム生化学研究室教授として、がん・自己免疫疾患の細胞免役療法に関する研究を行っている。
また東京医科歯科大学医学部(呼吸器科)非常勤講師を平成14年より兼務し、呼吸器疾患の臨床分子免役レベルでの発症機構解析を共同で行う。
平成24年3月同大学を定年退職。平成24年4月現在GSバイオメディカル研究所の所長、NPO法人ポピュレーションヘルス協議会の理事を務める。
著書/医薬必携生化学(廣川書店)、医薬品の開発と生産-レギュラトリーサイエンスの基礎(じほう)、生化学(朝倉書店)など、専門分野(臨床医科生化学・遺伝学)における論文著書多数。 これまでの経験を活かして、遺伝子活性化の観点から栄養・健康食品の啓蒙活動を行う。また、以前いたアメリカの研究所と”乳がん発症の予防”に関する共同研究を行う予定。
特許
US Patent Number(US特許):6,001,569(December 14,1999)
“Methods of screening for Crohn’s disease using TNF microsatellite alleles(TNFマイクロサテライト遺伝子を用いたクローン病患者スクリーニング法)”
US Patent Number(US特許):5,763,591(June 9,1998)
“Polynucleic acid sequences that are functionally associated with the development of autuimmune disease(自己免疫疾患発症に関与する遺伝子塩基配列について)”

